· 專家共識 ·
胃食管反流病(gastroesophageal reflux disease, GERD)是常見的消化系統疾病,其發病率有逐年增高的趨勢[1]。2006 年、2007 年和2014 年我國發布了GERD 內科診治指南[2-4],對指導GERD 的臨床診治發揮了重要作用。近年由于外科手術干預在GERD 的臨床實踐和研究中的應用,迫切需要國內外科診療共識意見來規范治療,為從事本專業的臨床醫師提供診療綱領,指導相關學科專業醫師正確認識和處理此類疾病。
GERD 是指胃內容物反流入食管、口腔(包括喉部)或肺所致的癥狀或并發癥[5]。GERD 的典型癥狀是燒心和反流,燒心指胸骨后燒灼感,反流指胃內容物向咽部或口腔方向流動的感覺。不典型癥狀有胸痛、上腹痛、上腹部燒灼感、噯氣等。GERD 還伴隨食管外癥狀,包括咳嗽、咽喉癥狀、鼻竇炎、復發性中耳炎、哮喘和牙蝕癥等。對于合并食管裂孔疝的患者,部分合并貧血。GERD 臨床上一般分為糜爛性食管炎(erosive esophagitis, EE) 或 反 流 性 食 管 炎 (reflux esophagitis, RE)、非糜爛性食管炎(non-erosive refiux disease, NERD) 和 Barrett 食 管 (Barrett esophagus,BE)3 種類型[5]。
正常情況下,食管抗反流防御機制和反流物對食管黏膜攻擊作用處于平衡狀態,當前者防御機制下降或者后者攻擊作用增強,平衡打破,就可能導致GERD。抗反流防御機制下降,包括食管下括約肌(low esophageal sphincter,LES)功能失調致抗反流能力減弱以及食管對反流物的清除能力下降等。食管黏膜屏障功能減弱,包括上皮前、上皮及上皮后屏障。當屏障功能受損時,即使在正常反流情況下,亦可致RE。各種原因引起的胃排空不良可以使近端胃擴張,引發一過性食管下括約肌松弛(transitloweresophagealsphincterrelaxation, TLESR),是反流形成的誘因之一。引起GERD 的機制是復雜的,往往是多因素共同作用的結果[6]。
GERD 診斷標準:(1)有反酸、燒心、胸骨后疼痛等典型癥狀者;(2) 質子泵抑制劑實驗陽性者;(3)內鏡檢查提示RE 陽性者;(4)24 h 食管 pH 監測陽性者;(5) GredQ 量表對燒心、反流、上腹痛、惡心、有無睡眠障礙和是否需要服用非處方藥物這6 項癥狀在1 周內的發作頻率進行評分, 將燒心、反流、有無睡眠障礙和非處方藥物服用頻率按 0、1、2~3、4~7 d 分別評為 0、1、2、3 分;(6)將上腹痛和惡心的發作頻率,按0、1、2~3、4~ 7d分別評為3、2、1、0 分,總分18 分,≥8 分即可診斷為GERD[7] ;(7)高分辨率食管測壓(high resolution manometry, HRM) 可明確是否合并食管裂孔疝。其36 通道固態高分辨率食管測壓系統,含36 個固態環周壓力測量通道,每通道包括12 個由電容式壓力感受器構成的環繞測壓點,可對整段食管的張力及蠕動收縮情況進行同步監測。食管裂孔疝患者的食管測壓主要表現為食管下段出現雙壓力帶,呼吸壓力反轉點下移,LES 壓力下降,低于正常值。HRM 還能夠反映食管的運動功能,為手術方式的選擇提供依據[8]。GERD 的治療目標包括有效緩解癥狀、治愈食管炎、提高生命質量和預防并發癥。共識意見將生活方式的改變作為治療的首要前提,指出減肥、戒煙、抬高床頭、左側臥位等生活方式的改善應作為治療的一部分,并避免睡前進食和食用可能導致反流的食物如咖啡、巧克力、辛辣、酸性食物以及高脂食物。(一) 質子泵抑制劑(proton pump inhibitor, PPI)治療為重點 PPI 仍然是治療GERD 的首選藥物。共識意見建議:如單劑量PPI 治療無效可換用雙倍劑量;如一種PPI 治療無效,可選用其他PPI 進行治療。研究顯示,GERD 治療中最優胃酸抑制需要在24 h 中使胃內pH>4 的時間達到16 h,在療程方面,共識意見認為PPI 治療GERD 使用療程至少8 周。與治療4 周相比,治療8 周可將癥狀緩解率和食管炎愈合率提高10%以上[5]。合并食管裂孔疝的GERD 患者以及洛杉磯分級(LA)-C 級、LA-D 級的患者, PPI 劑量應加倍。GERD 的維持治療方法主要包括:(1)持續維持:指當癥狀緩解后維持原劑量或半量PPI 每日1 次,長期使用;(2)間歇治療:指PPI 劑量保持不變,但延長用藥周期,最常應用的是隔日療法;在維持治療中,若癥狀反復出現,應增至足量PPI 維持;(3)按需治療:是指經初始治療成功后停藥觀察,一旦出現燒心、反流癥狀,隨機再用藥至癥狀消失。共識意見指出,對NERD 及輕度食管炎(LA-A 級和LA-B 級)停藥后癥狀復發者,可采用PPI 按需維持;重度食管炎(LA-C 級和LA-D 級) 及BE 患者通常需要PPI 持續維持。但西方國家認為長期使用PPI 有造成難辨梭狀芽孢桿菌感染的可能,我國尚無此類研究證實。
手術及內鏡治療為有條件選擇。對PPI 治療有效但需要長期服藥的患者,抗反流手術是另一治療選擇,最常見的方式是腹腔鏡胃底折疊術,而內鏡治療(包括射頻治療、注射或植入技術、內鏡腔內胃食管成形術)的長期有效性尚待進一步證實。1.手術適應證:(1)內科治療無效的GERD 以及相關并發癥如食管炎、食管狹窄、BE;(2)最大藥物治療效果癥狀仍不緩解;(3)伴有有癥狀的食管旁疝;(4)患者拒絕PPI 治療;(5)不能耐受藥物副作用;(6)影響生活質量的GERD 引起的食管外癥狀如反流性哮喘、反流性咳嗽、反流性胸痛、反流性睡眠障礙等[9-10]。 2.手術應用補片的適應證:(1)巨大型食管裂孔疝,食管裂孔缺損超過5 cm,或超過1/3 胃體疝入胸腔。(2)對于膈肌腳發育不良、肌纖維薄弱的患者,單純縫合修補后,隨著呼吸運動及吞咽運動,膈肌腳與橫膈的肌纖維容易撕裂,導致食管裂孔疝復發。(3)若患者同時伴有各種慢性疾病(如肥胖、便秘、前列腺增生、慢性支氣管炎、頑固性呃逆等),易導致腹內壓力增高,將腹腔內臟器向食管裂孔處擠壓,并通過食管裂孔疝入胸腔。 3.術前檢查:(1)胃鏡檢查:胃鏡檢查為術前必須。燒心和(或)反流是GERD 的典型癥狀,但其特異度僅約70%,由于胃腸道惡性腫瘤在我國多數地區發病率較高,胃鏡直視下可以診斷食管裂孔疝以及上消化道腫瘤,避免貽誤診斷。還可以了解有無賁門失遲緩癥、胃炎、十二指腸炎、消化道潰瘍、RE 的分級以及BE,可以說胃鏡檢查是術前檢查的最為重要的環節之一。(2)上消化道造影:盡管上消化道造影在GERD 的診斷方面敏感度和特異度均很低,但可了解胃和食管的解剖結構,在診斷食管裂孔疝中有重要作用。對于GERD 合并食管裂孔疝的患者,上消化道造影可以對食管裂孔疝進行分型,了解疝內容物,有無短食管,同時鑒別彌漫性食管痙攣、賁門失遲緩、食管環等。要注意的是,應進行胃鏡和CT 檢查后再進行鋇餐檢查,避免鋇劑掩蓋病變。(3) 食管測壓與 24 h pH 監測:為術前評估的重要內容。食管測壓的主要作用是排除賁門失遲緩癥,還可以明確患者食管蠕動功能和確定LES 的位置。食管24 h pH 監測是診斷GERD 的金標準,它為異常反流提供了客觀依據。對于計劃行腹腔鏡食管裂孔疝修補和胃底折疊手術,沒有進行食管測壓和24 h pH 監測是危險的行為。因為術前如果不了解食管運動功能、食管壓力和患者反酸的程度,術后有時可能會產生嚴重的食管運動障礙。如賁門失遲緩癥和食管無效運動為主的食管運動障礙的患者也會產生嚴重的反酸、燒心與胸痛癥狀,如果直接給予胃底折疊手術會導致嚴重的梗阻后果,另外本項檢查也是評價手術或藥物治療效果的客觀依據。(4)CT 檢查(圖1):對于合并食管裂孔疝的患者,應常規行CT 檢查,進行胸腹腔容積、疝囊容積測定,以了解疝囊容積與腹腔容積的比值,為術前制定手術方案提供依據,同時防止疝內物還納腹腔后發生呼吸窘迫和腹腔間室綜合征。(5)GerdQ 量表:GerdQ 量表是癥狀調查問卷中最為常用的,該量表以自我評估的方式對GERD 進行診斷,要求患者反映就診前1 周內出現的癥狀。僅對癥狀的頻度進行分級評分,使用GerdQ 量表診斷GERD 的準確性與胃腸專科醫師類似,且能評估疾病對患者生活的相關影響,有助于治療選擇及衡量治療效果。(6)心理評估:對于手術患者,臨床醫師應進行心理評估及疾病知識宣教, 耐心解釋GERD 的相關知識,使患者能夠正確認識疾病,消除患者的畏懼心理。這也是術前不容忽視的一部分。(7) 其他常規術前檢查:包括常規的血液檢查,如血常規、生化、相關傳染病檢查、血氣分析等,還有心電圖、胸部X 線檢查、肺功能、心臟超聲檢查等了解有無其他基礎疾病,并評估患者是否能耐受全身麻醉。
手術是需長期治療患者的選擇。GERD 可選術式包括腹腔鏡下胃底折疊術和針對肥胖患者的減肥手術。患者選擇手術的原因可能包括需要中斷藥物治療、依從性差、藥物治療相關副作用、巨大食管裂孔疝、中重度貧血、藥物難治性食管炎或是難治性GERD 引起的持續癥狀存在。腹腔鏡下胃底折疊術治療GERD 有效,療效持久,因此可作為需長期藥物治療者的選擇。PPI 治療無效者一般不推薦手術治療。手術療效最佳者為有典型胃灼熱和(或) 反流癥狀,且PPI 治療應答良好和(或)動態食管反流監測證實癥狀與反流密切相關[11]。這些患者手術治療長期效果與藥物治療相當甚至更好。而PPI 治療無效者中有很大部分不是真正的GERD,因此一般不推薦手
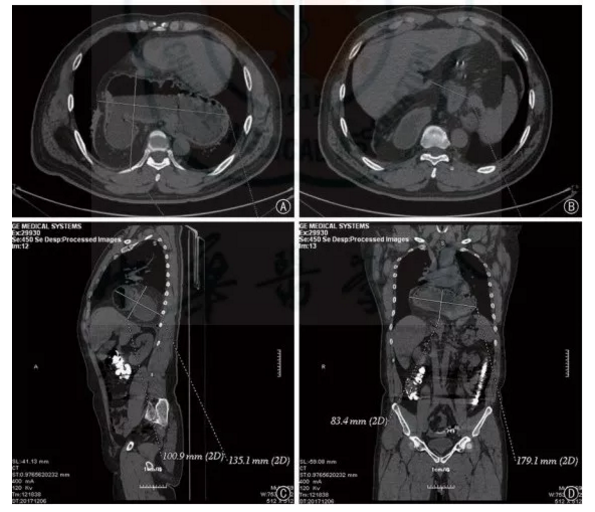
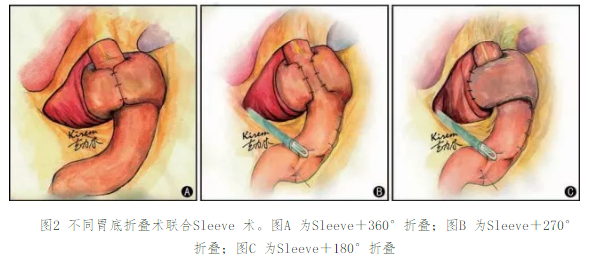
圖1 容積測定。圖A 示胃腔及局部腹腔內脂肪經食管裂孔向上疝入縱隔后方;圖B 示測量疝囊口直徑約60.3 mm;圖C 示測量側位疝囊最大徑和最小徑;圖D 示測量正位疝囊最大徑和最小徑。通過計算得出:疝囊大小約134 mm×186 mm,疝囊容積約1476.4 cm3術治療。據本課題組的經驗,對于嚴重反流或是以膽汁反流為主的GERD,PPI 治療多無效,這時需要臨床醫師根據患者的病情以及針對GERD 相關檢查的結果綜合判斷,對于診斷明確的GERD 手術亦會取得不錯的效果[12]。 無NERD 證據的患者必須行術前動態食管反流監測;所有患者均應行術前食管測壓以排除賁門失弛緩癥或硬皮病樣食管。部分非糜爛性反流性疾病患者的癥狀并非反流,因此必須經動態食管反流監測證實。有食管動力異常者,如賁門失弛緩癥或硬皮病樣食管患者是Nissen 手術禁忌證。審慎選擇的GERD 患者在有經驗的外科醫師行手術后,療效與藥物治療相當。審慎選擇的患者符合以下要求:(1)對PPI 治療有良好應答;(2)無糜爛者經食管反流監測證實有反流;(3)食管測壓排除食管動力異常。總體上手術療效與藥物治療相當,有經驗的外科醫師實施手術,安全性很高。采用手術治療的患者中多數PPI 治療無良好應答,這些患者術后大部分仍取得滿意療效,本課題組的經驗是只要診斷明確,適應證選擇正確,仍可通過手術使大多數此類患者獲得很好的療效[13];另外,藥物只是控制胃酸的產生,并不能控制反流,而手術是重建抗反流機制。肥胖患者準備實施GERD 手術時,應考慮同時行減肥手術,首選方式是胃旁路手術。2009年的1篇綜述通過調查問卷方式評價了行減肥手術的GERD 患者的療效[14],提示Roux-en-Y胃旁路術后GERD患者癥狀改善的效果優于胃束帶手術。目前花榮等[15] 采取的Nissen 胃底折疊聯合大彎側折疊也顯示了良好的近期效果。克力木教授獨創的不同胃底折疊術聯合Sleeve 術(圖 2) 對肥胖患者提供了新的選擇,并在國內開始推廣。不推薦目前應用的內鏡下治療和經口無切口胃底折疊術作為藥物治療或傳統手術的替代治療( 有條件的推薦, 循證等級:中)。目前進行中的各種內鏡下治療未能顯示長期療效[16]。新近發展的作為替代的經口無切口胃底折疊術也未能顯示長期(36 個月)療效[17-18],因此也不予推薦。但我國有研究報道內鏡下食管微量射頻治療的近2000 例患者,多數顯示了長期療效[19]。GERD 患者不同胃底折疊術式的選擇可以參考食管測壓與24 h 食管pH 監測的結果,并且可以根據術前LES 壓力的變化情況,選擇性地進行抗反流術式。24 h 食管pH 監測可以反映GERD 患者反流的頻率以及持續時間,反流與哮喘或咳嗽以及其他相關癥狀是否關聯,不同體位與反流的關系。通過De Meester 評分判斷患者的反流屬于病理性或生理性,充分評估手術的必要性,減少主觀因素造成的過度手術治療。根據反流的嚴重程度和LES 壓力以及食管運動功能確定哪些患者進行 360°全包繞胃底折疊和部分包繞折疊。術中測壓可以精準地計算LES 在抗反流手術后的位置與壓力。因此本課題組根據食管測壓和24 h 食管pH 監測制定了選擇抗反流術式的參考流程(圖3、4)。
1. 置入套管:患者全身麻醉后,取仰臥、頭高腳低右傾斜位,常規消毒,鋪無菌巾。臍孔穿刺, 建立CO2氣腹至12~15 mmHg(1 mmHg=0.133 kPa)。
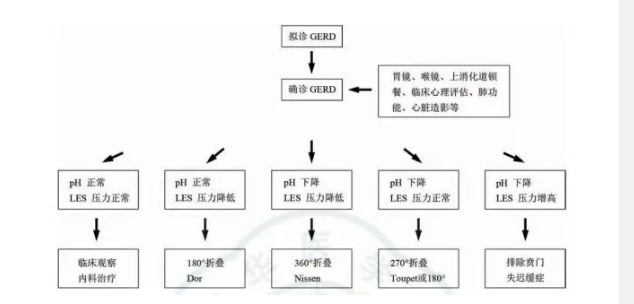
注:GERD 為胃食管反流病,LES 為食管下括約肌圖3 根據食管測壓和24 h 食管pH 監測選擇抗反流術式的參考流程
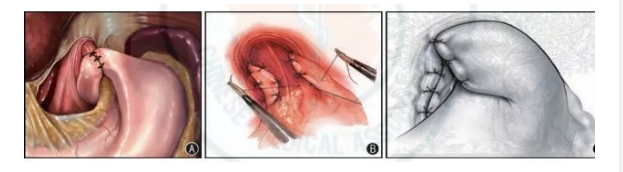
圖4 目前常用的3 種不同抗反流術式。圖A 為360°折疊;圖B 為270°折疊;圖C 為180°折疊置入5 個套管,臍部10~12 mm 套管放置30°腹腔鏡作為觀察孔,分別于兩側肋緣下鎖骨中線處、左側腋前線臍水平上約5 cm,插入10 mm、5 mm/5 mm 的套管作為操作孔,于劍突下正中偏左做一3 mm 小切口插入3 mm 粗細倒“7”字形鈍頭鋼絲吊牽肝左葉。 2. 探查腹腔:置入腹腔鏡,觀察腹腔有無損傷,肝、膽、脾、胃、腸、盆腔有無異常。 3. 暴露膈肌腳:用超聲刀切開近段胃小彎的肝胃韌帶,游離食管賁門右側,顯露右側膈肌腳并此處標志性留置一塊干紗布,然后超聲刀切開胃脾韌帶,游離胃底和食管賁門左側,使食管下段賁門周圍完全游離,并使兩側膈肌腳充分顯露,可見食管裂孔缺損大小,還納疝內容物入腹腔。后方,將雙側膈肌腳間斷縫合關閉疝環(若缺損較大可放置補片)。 5. 放置補片:將補片放置于食管裂孔處,將補片展平后縫合固定于兩側膈肌腳上。補片上緣距離食管應有 1 cm 左右的距離, 避免補片摩擦損傷食管。 6. 胃底折疊:(1)Nissen 法為將左側胃底穿過食管后方側胃底與右側胃底前壁縫合2~3 針。胃底包繞食管1 周即完成食管周圍的360°全包繞,胃底外緣與右側膈肌腳縫合固定l 針。(2)Toupet 法為將左側胃底穿過食管后方側胃底與右側胃底前壁縫合2~3 針。胃底包繞食管3/4 周即完成食管周圍的270°包繞。(3)Dor 法為食管左側胃底通過食管前方,包繞食管,與膈肌腳縫合2~3 針。完成食管前方的180°胃底折疊。根據手術中具體情況及患者凝血功能等決定是否置入腹腔引流管。1. 出血:術中損傷肝左動脈、下腔靜脈、胃短動脈,及分離脾胃韌帶、處理脾門胰尾因操作不當造成損傷或者粗暴牽拉肝臟、脾臟引起損傷均可導致術中或術后出血。術中應仔細操作,避免損傷血管及臟器。2. 迷走神經損傷:迷走神經損傷可導致胃張力減低、運動減弱、胃內容物排空延遲,吞咽困難。熟悉解剖,術中避免迷走神經的損傷。3. 食管或胃穿孔:食管或胃穿孔是較嚴重的并發癥, 發生率約 1%。患者術后若出現腹痛、發熱,腹肌緊張,腹部壓痛反跳痛,腹腔引流管引出渾濁的液體,則高度懷疑并發胃或食管穿孔。進一步的消化道造影可明確診斷。4. 氣胸:氣胸的發生率為2%~3%,多為游離膈上食管所致。少量氣胸可自行吸收,若患者出現胸悶、呼吸困難、呼吸音減弱等癥狀、體征,則說明患者存在氣胸。胸部X 線檢查可確診。少量氣胸可自行吸收,大量氣胸則需胸腔閉式引流。5. 臟器損傷:手術除了可造成食管和胃損傷外,還可因手術牽拉或放置Trocar 損傷肝臟、脾臟、大網膜血管。小心操作, 盡量避免臟器的損傷。6. 術后吞咽困難:吞咽困難是術后常見的并發癥,其發生率約17%,尤其是術后早期。術后吞咽困難持續時間較短,術后指導患者從流食逐漸過度到普食,吞咽困難可逐步改善。 8. 復發:發生率各研究報道不同(0~42%), 大的食管裂孔疝患者、肥胖患者(體質量指數> 35 kg/m2)、食管過多游離等容易術后復發。術中不可吸收縫線縫合膈肌腳,正確使用選擇和放置補片。術前準備積極處理GERD 患者伴有的全身性疾病。嚴密監測呼吸功能,包括常規胸部X 線檢查、肺功能及血氣分析。對伴有呼吸功能不全的患者要進行充分的術前準備:肺部有感染者,術前應用抗生素治療,感染控制后1 周再行手術。通過1~2 周的呼吸肌煅煉。吸煙者術前2 周停止吸煙。對于合并食管裂孔疝的患者,特別是疝囊容積與腹腔容積的比值較大的,首先應行胸腹腔容積、疝囊容積測定,了解疝囊容積大小,為防止疝內物還納腹腔后發生呼吸窘迫和腹腔間室綜合征,術前應進行相應腹腔擴容及腹肌順應性訓練。推薦經過以上準備措施實施2~3 周后,患者的肺功能明顯改善后再進行手術。對于巨大的復雜的合并食管裂孔疝的患者術前還應重視腸道的準備。對于合并貧血的患者,首先應進行血常規、貧血4 項等相關檢查,排除血液系統相關疾病,根據患者自身情況,可適當術前預防應用抗生素,以降低手術切口感染發生率,特別是對于高齡、糖尿病、免疫功能低下、巨大或多次復發食管裂孔疝患者。術后抗生素的應用根據患者情況而定。術后早期患者可在床上活動,24 h 后可下床活動;但術后早期禁止劇烈活動和重體力勞動。本共識為GERD 外科診療共識,旨在為符合手術指征的GERD 患者及臨床醫師提供規范的外科診療依據。今后隨著醫學進步和臨床證據的累積與更新,本課題組還將定期對共識進行討論、修訂和更新。




